在生物醫學研究中,單細胞懸液的制備是許多實驗的基礎步驟,但傳統方法往往耗時費力且效率低下。如今,隨著技術的不斷進步,單細胞懸液制備儀迎來了重大升級,除了現有的加熱模塊,又新增了灌流模塊與冷凍模塊!這一創新不僅極大地簡化了實驗流程,還顯著提高了懸液制備的效率和細胞活性,為科研人員帶來了實驗的便利。
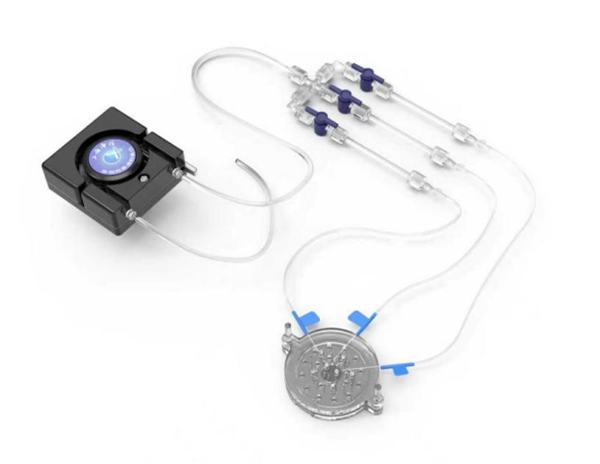
灌流模塊:給組織來場 “深度清潔”,告別雜質干擾
對于肝臟等富含血細胞的組織樣本,血細胞的殘留會嚴重影響單細胞懸液的純度,進而干擾實驗數據的準確性。而灌流模塊,正是解決這一痛點的 “清潔專家”。
它以 PBS 緩沖液為 “清潔介質”,通過精準的灌流系統持續作用于肝臟組織。在溫和且穩定的灌流壓力下,PBS 緩沖液會充分滲透組織內部,將藏在血管、組織間隙中的血細胞徹底沖刷出來。整個過程就像給肝臟做了一次深度凈化 SPA,直到肝臟外觀由紅轉白,流出的液體變得清澈透亮,就意味著灌流完全完成。
經過灌流模塊處理后,組織樣本中的雜質被大幅去除,為后續單細胞的分離提取掃清了障礙,從源頭保證了懸液的純度。

冷凍模塊:兩端分別連接冷水機的進水口、出水口,進行低溫水循環,維持低溫環境,進行單細胞核懸液制備。
單細胞懸液制備儀設備的優點在哪?
單細胞懸液制備過程中,細胞的活性是重中之重。儀器除了加熱模塊,維持37度恒溫,還有冷凍模塊,維持單細胞核制備所需的低溫。
該模塊兩端分別與冷水機的進水口、出水口相連,構建起一套閉環的低溫水循環系統。通過持續循環的低溫水流,能將制備環境的溫度穩定控制在 0-4℃度范圍。
保護核結構完整性,避免核破裂
細胞核由核膜包裹遺傳物質(DNA、染色質等),常溫下細胞裂解、核分離過程中,機械力(如研磨、吹打)和化學試劑(如裂解液)易導致核膜破裂,遺傳物質流失或降解。0-4℃的低溫能降低核膜的流動性,增強核膜穩定性,減少操作過程中核結構的損傷,確保細胞核形態完整。
抑制核酸酶活性,防止遺傳物質降解
細胞內及環境中存在天然的核酸酶(如 DNase、RNase),這類酶在常溫下活性較高,會降解細胞核內的 DNA 或 RNA,導致后續測序、基因分析等實驗數據失真。低溫能顯著抑制核酸酶的活性,阻斷其對遺傳物質的降解作用,最大程度保留細胞核內的原始遺傳信息。
減少非特異性反應,提升懸液純度
常溫下,細胞裂解后釋放的蛋白質、細胞器碎片等易與細胞核發生非特異性結合,或相互聚集形成復合物,增加后續分離純化的難度。低溫可降低分子運動速率,減少這類非特異性結合和聚集現象,幫助獲得更純凈的單細胞核懸液,為后續實驗(如單細胞核測序)提供高質量樣本。
模塊各司其職,完成高質量實驗
灌流模塊的 “精準清潔” 與冷凍模塊的 “低溫守護”,形成了一套完整的樣本制備解決方案。從去除雜質、提升純度,到保留活性、保障質量,兩大模塊各司其職,讓單細胞懸液制備、單細胞核懸液制備,變得高效、穩定、可重復。
上海凈信單細胞懸液制備儀的新增模塊,為生物醫學研究提供了強大的技術支持。無論是單細胞核的高效提取,還是肝臟灌流的精準操作,都讓實驗變得更加輕松高效。這一創新不僅提升了實驗的成功率,還為單細胞研究的廣泛應用奠定了堅實基礎,助力科研人員在生命科學領域取得更多突破!
上一篇:單細胞懸液制備儀實現99.36%超高活率,破解樣本損傷難題
下一篇:沒有了!